悪性腫瘍(癌)とDIC:病型分類
DIC病型分類に関する欧文論文:Classifying types of disseminated intravascular coagulation: clinical and animal models. Journal of Intensive Care 2014, 2: 20.
【DIC病型分類と悪性腫瘍】
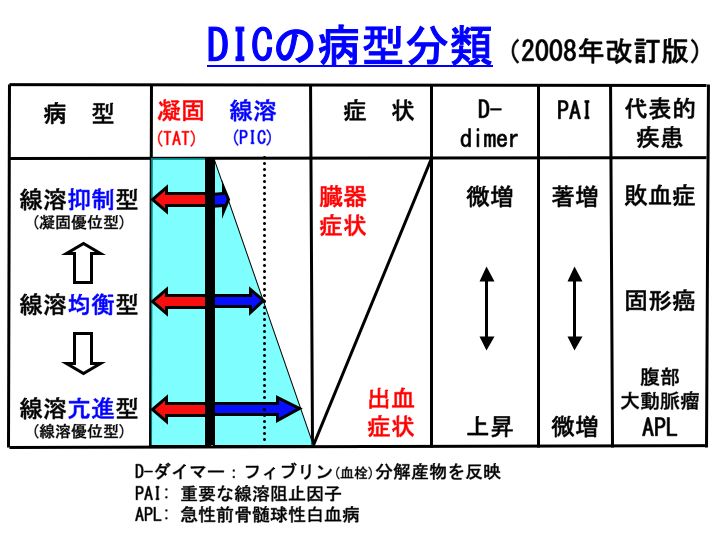
DIC病態を理解する上で、DICの病型分類の概念は重要です。著しい凝固活性化はDICの主病態であり全症例に共通していますが、その他の点については基礎疾患により病態(特に線溶活性化の程度)が相当異なっています。
凝固活性化は高度であるものの線溶活性化が軽度に留まるDICは、敗血症に合併した例に代表されます。線溶阻止因子PAIが著増するために強い線溶抑制状態となり、多発した微小血栓が溶解されにくく微小循環障害による臓器障害が高度になりやすいのですが、出血症状は意外と軽度です。
このような病型のDICを「線溶抑制型DIC」と称しています。検査所見としては、凝固活性化マーカーであるTATは上昇するものの、線溶活性化マーカーであるPICは軽度上昇に留まります。また、微小血栓の溶解を反映するFDPやDダイマーも軽度上昇に留まるのが特徴です。
一方、凝固活性化に見合う以上の著しい線溶活性化を伴うDICはAPL、腹部大動脈瘤、前立腺癌などに合併した例に代表されます。PAIはほとんど上昇せずに線溶活性化が強く、止血血栓が溶解されやすいことと関連して、出血症状が高度になりやすいけれども臓器障害はほとんどみられません。
このような病型のDICを「線溶亢進型DIC」と称しています。検査所見としては、TAT、PIC両者とも著増し、FDPやDダイマーも上昇します。フィブリノゲン分解も進行するためにFDP/DD比は上昇(DD/FDP比で表現する場合は低下)しやすいのも特徴です。
凝固・線溶活性化のバランスがとれており上記両病型の中間的病態を示すもの(固形癌に合併したDICなど)を「線溶均衡型DIC」と称しています。進行例を除くと、出血症状や臓器症状は意外とみられにくいです。
固形癌に合併したDICの多くは線溶均衡型DICの病態となり、比較的慢性の経過をとりやすいです。
ただし、固形癌においても一部は線溶亢進型DICとなる場合があります。例えば、前立腺癌、悪性黒色腫、大腸癌、膵癌などにおいて全身転移を伴った進行癌の場合に線溶亢進型DICとなり、しばしば高度の出血症状のコントロールに難渋します。
造血器悪性腫瘍に合併したDICのうち、APLは線溶亢進型DICを併発しやすいですが、APL以外の急性白血病においても線溶亢進型DICの病態になりやすく、出血のコントロールがDIC治療の中心となります。悪性リンパ腫などその他の造血器悪性腫瘍においては、線溶均衡型〜線溶亢進型DICの病態となります。
DIC病型分類の概念は、DICの早期診断、治療方針の決定の上でも重要です。
たとえば、FDP 、DダイマーはDIC診断の最も重要なマーカーと信じられてきましたが、線溶抑制型DICではその上昇は軽度にとどまることも少なくなく、これらのマーカーを過度に重用視するとDICの診断が遅れる懸念があります(血中TAT、SFの上昇や、血小板数の経時的低下に着目することにより早期診断が可能です)。
治療面においても、線溶亢進型DICに対して、ヘパリン類のみを投与すると出血を助長することも少なくありません。なお、悪性腫瘍に合併したDICの治療関連の記事は後日になります。
(続く)
【シリーズ記事】
研修医の広場(金沢大学第三内科) ← 当科での研修の様子をご覧いただくことができます。
投稿者:血液内科・呼吸器内科at 11:10 | DIC | コメント(0)
悪性腫瘍(癌)とDIC:APL、アネキシンII
悪性腫瘍(癌)とDIC:発症機序から続く
【悪性腫瘍、APLとアネキシンII】
急性前骨髄球性白血病(APL)に合併したDICにおいて線溶活性化が著しい理由として、APL細胞表面上に存在するアネキシンII(annexin II)の果たす役割が大きいことが知られています。
Menell JS, Cesarman GM, Jacovina AT, McLaughlin MA, Lev EA, Hajjar KA: Annexin II and bleeding in acute promyelocytic leukemia. N Engl J Med 340, 994-1004. 1999.
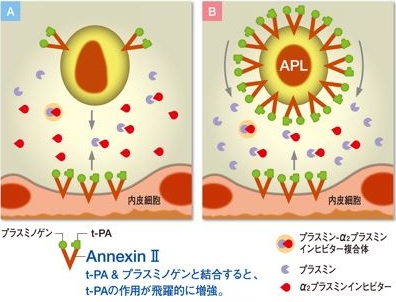
アネキシンIIは、血管内皮細胞、マクロファージ、いくつかの腫瘍細胞などの表面に発現しているCa++/リン脂質結合性の細胞表面膜受容体です。
アネキシンIIは、組織プラスミノゲンアクチベータ(t-PA)およびプラスミノゲンの両者と結合し、このことによりt-PAによるプラスミノゲンの活性化が飛躍的に亢進するために線溶活性化を増強することが知られています。
急性前骨髄球性白血病(APL)における著しい線溶活性化の原因として、従来、線溶阻止因子PAIの発現があまりみられないことや、顆粒球エラスターゼによるPAI、α2PI、フィブリン、フィブリノゲンの分解が指摘されてきましたが、これらに加えてアネキシンIIの果たす役割は極めて大きいと考えられます。
アネキシンIIは、APL以外にもいくつかの他の癌細胞にも発現していることが知られており、癌の浸潤、転移、血管新生との関連が注目されています。
Madoiwa S, Someya T, Hironaka M, Kobayashi H, Ohmori T, Mimuro J, Sugiyama Y, Morita T, Nishimura Y, Tarumoto T, Ozawa K, Saito K, Sakata Y: Annexin 2 and hemorrhagic disorder in vascular intimal carcinomatosis. Thromb Res 119: 229-240, 2007.
Ohno Y, Izumi M, Kawamura T, Nishimura T, Mukai K, Tachibana M: Annexin II represents metastatic potential in clear-cell renal cell carcinoma. Br J Cancer 101: 287-294, 2009.
Shiozawa Y, Havens AM, Jung Y, Ziegler AM, Pedersen EA, Wang J, Wang J, Lu G, Roodman GD, Loberg RD, Pienta KJ, Taichman RS: Annexin II/annexin II receptor axis regulates adhesion, migration, homing, and growth of prostate cancer. J Cell Biochem 105: 370-380, 2008.
固形癌に合併したDIC症例において著しい線溶活性化に伴い高度な出血傾向をきたす症例を時に経験しますが、このような症例において高頻度にアネキシンIIの発現がみられるかどうか興味のあるところです。
また、急性前骨髄球性白血病(APL)に対する全トランスレチノイン酸(ATRA)によりアネキシンIIの発現が強く抑制されるように、アネキシンIIを制御するような治療が可能になれば、線溶活性化と癌浸潤の両者を調節できる治療法が登場することになるかも知れません。
なお、アネキシンIIは腹部大動脈瘤の進展とも関連しており、腹部大動脈瘤に合併することで知られる線溶亢進型DICとの関連も興味ある研究課題ではないかと思われます。
Hayashi T, Morishita E, Ohtake H, Oda Y, Ohta K, Arahata M, Kadohira Y, Maekawa M, Ontachi Y, Yamazaki M, Asakura H, Takami A, Nakao S: Expression of annexin II in human atherosclerotic abdominal aortic aneurysms. Thromb Res 123: 274-280, 2008.
Hayashi T, Morishita E, Ohtake H, Oda Y, Asakura H, Nakao S: Expression of annexin II in experimental abdominal aortic aneurysms. Int J Hematol. 2009 Sep 16. [Epub ahead of print]
【シリーズ記事】
研修医の広場(金沢大学第三内科) ← 当科での研修の様子をご覧いただくことができます。
投稿者:血液内科・呼吸器内科at 08:55 | DIC | コメント(0)
悪性腫瘍(癌)とDIC:発症機序
【DIC発症機序:悪性腫瘍】
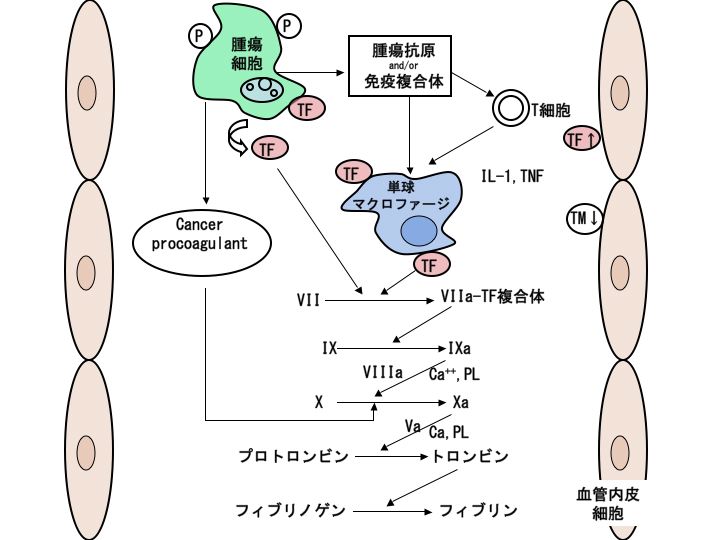
悪性腫瘍における播種性血管内凝固症候群(DIC)発症の主因は、腫瘍細胞表面および腫瘍細胞中に含まれる組織因子による外因系凝固機序の活性化と考えられています。
その他には、腫瘍細胞に対する免疫反応により単球/マクロファージが刺激され、単球/マクロファージより組織因子が産生される機序や(この際、リンパ球が介在してサイトカインの働きにより組織因子産生が増幅される可能性があります)、悪性腫瘍患者において誘導されるTNF、IL-1と言ったサイトカインが血管内皮細胞に作用し、血管内皮細胞における組織因子が産生が亢進したり、トロンボモジュリンの発現が抑制されることにより、血管内皮細胞の性格が抗凝固から向凝固にシフトされることなどが考えられています。
ただし、このような腫瘍に対する免疫反応やサイトカイン産生などに伴う凝固活性化の機序(単核球や血管内皮細胞を巻き込んだ凝固活性化の機序)は、敗血症に合併したDICと比較するとはるかにそのグレードは小さいものと考えられています。
腫瘍細胞からは、組織因子のみならずcancer procoagulant(第X因子を直接活性化するシステインプロテアーゼであり、VIIa、IXaなどのセリンプロテアーゼとは第X因子の切断部位が異なります)も放出されています。cancer procoagulantは、ヒト胎盤、肺癌、大腸癌、白血病細胞に存在し、癌特異性が比較的高いとされていますが、実際の臨床症例においてどの程度凝固活性化に関与しているかどうかについては議論の余地があります。
固形癌症例においては、血中トロンビン-アンチトロンビン複合体(TAT)やプロトロンビンフラグメント1+2(F1+2)は高値で、組織因子は2/3例、活性型第VII因子(FVIIa)は半数例で異常高値であったのに対し、内因系凝固活性化のマーカーである活性型第XII因子(FXIIa)はごく一部の症例でのみ高値であったとする報告がみられています。
Kakkar AK, DeRuvo N, Chinswangwatanakul V, Tebbutt S, Williamson RC:Extrinsic-pathway activation in cancer with high factor VIIa and tissue factor. Lancet 346(8981):1004-1005, 1995.
この報告からも、固形癌における凝固活性化機序は、組織因子の関与する外因系凝固活性化が主体であろうと考えられます。
(続く)
【シリーズ記事】
研修医の広場(金沢大学第三内科) ← 当科での研修の様子をご覧いただくことができます。